Neue Zweifel an der Datenintegrität der Pfizer-mRNA-Studie

Das folgende ist eine Übersetzung des Blogposts vom 30.11.2021:
https://maryannedemasi.com/publications/f/fresh-doubts-over-data-integrity-in-pfizer-mrna-trial
von Maryanne Demasi, PhD
Eine Whistleblowerin berichtet

Durchgesickerte Dokumente haben neue Zweifel an der Integrität der Daten aus Pfizers entscheidender COVID-19-Impfstoffstudie geweckt und deuten darauf hin, dass die Probleme bei Ventavia andauern.
Anfang dieses Monats äußerte die Whistleblowerin Brook Jackson gegenüber dem BMJ ernsthafte Bedenken hinsichtlich „gefälschter Daten“ in Pfizers mRNA-Studie (Comirnaty). Die Bedenken wurden von zwei ehemaligen Ventavia-Mitarbeitern bestätigt.
Die Behörden waren schnell dabei, die Angst der Öffentlichkeit zu zerstreuen.
Die Arzneimittelaufsichtsbehörden in Australien (TGA) und den USA (FDA) gaben Erklärungen ab, in denen sie der Öffentlichkeit versicherten, dass sie den Daten voll vertrauen. Darüber hinaus überwögen die Vorteile des Pfizer-Impfstoffs die Risiken.
Hochrangige Forscher waren skeptisch. „Alle dieses vage Fuchteln, welches das BMJ veröffentlicht hat, machen es nicht mehr wahr“, sagte der Impfstoffexperte Dr. Paul Offit.
Ventavia, das in Texas ansässige Unternehmen im Zentrum der Kontroverse, veröffentlichte eine Erklärung, in der es in Bezug auf Frau Jackson behauptete, dass „kein Teil ihrer beruflichen Verantwortlichkeiten die fraglichen klinischen Studien betraf“.
Unbeirrt feuerte Frau Jackson zurück.
Ventavia und seiner Sprecherin Lauren Foreman wurde von Rechtsanwalt Robert Barnes im Namen der Whistleblowerin Jackson eine Unterlassungserklärung zugestellt.
Zu den Forderungen von Ventavia heißt es in dem Aufforderungsschreiben:
„Diese Aussage ist falsch. Diese Aussage greift den Ruf meiner Klientin Brook Jackson an und impliziert fälschlicherweise, dass sie ihre Arbeit an den klinischen Studien öffentlich falsch dargestellt hat.“
Rechtsanwalt Barnes fordert Ventavia auf, unverzüglich einen öffentlichen Widerruf zu erlassen und sich bei Frau Jackson „formell und öffentlich zu entschuldigen“.
Aus ihrem Anstellungsschreiben geht hervor, dass Frau Jackson am 7. September 2020 als „Regionaldirektorin“ von Ventavia eingestellt wurde. Sie verfügt über fast zwei Jahrzehnte Erfahrung in der Koordination und Verwaltung klinischer Studien.
Zu ihren Aufgaben gehörten die Überwachung des Betriebs, der Rekrutierung und der Qualitätssicherung der Studienzentren von Ventavia.

Die Dokumente
Frau Jackson hat mit https://maryannedemasi.com gesprochen und auf die Kritiker reagiert, die behaupteten, die von ihr erhobenen Anschuldigungen über die Pfizer-Prozesse seien unbewiesen.
Durchgesickerte Dokumente stützen die Beobachtungen von Frau Jackson und werfen noch mehr Fragen auf.
Es gab mehrere Beispiele für „Laborverarbeitungsprotokolle“, die von Mitarbeitern ausgefüllt wurden und eklatante Inkonsistenzen und Anomalien bei der Probenhandhabung enthielten.
Ventavia schien sich der Notwendigkeit von Verbesserungen bewusst zu sein, und Frau Jackson wurde mit dem Ziel eingestellt, die Qualitätskontrolle zu verbessern.
Unter den Dokumenten befindet sich eine Liste der herausragenden „Maßnahmenpunkte“ von Ventavia, die Gespräche mit den Studienkoordinatoren über die Integrität der Daten beinhalten.
Die Liste wurde vom 11. August 2020 datiert und zeigt, dass Ventavia bereits vor der Ankunft von Frau Jackson Bedenken hinsichtlich einer Datenfälschung hatte. (siehe Liste).

Frau Jackson sagte, die Arbeitsumgebung bei Ventavia sei chaotisch, sie seien unterbesetzt und die Studienteilnehmer würden aufgrund eines Rückstands bei Besuchen und Platzmangels unbeaufsichtigt auf dem Flur zurückgelassen.
Die Probleme waren laut Frau Jackson so ungeheuerlich, dass sie Ventavia vorschlug, „die Rekrutierung von Studienteilnehmern sofort zu unterbrechen“, um die Probleme anzugehen.
Am 17. September 2020 stimmte Ventavia Frau Jackson zu und forderte die Mitarbeiter auf, eine Liste „häufiger“ Qualitätskontrollverstöße zu erstellen, die überprüft werden sollten.
Zu den Verstößen gehörten unangemessene Einverständniserklärungen (ICFs), nicht verblindetes Personal (die Impfstoffzuweisung war auf den Formularen angegeben) und nicht übereinstimmende Unterschriften (laut Frau Jackson fälschten die Mitarbeiter Patientenunterschriften, wenn sie fehlten).
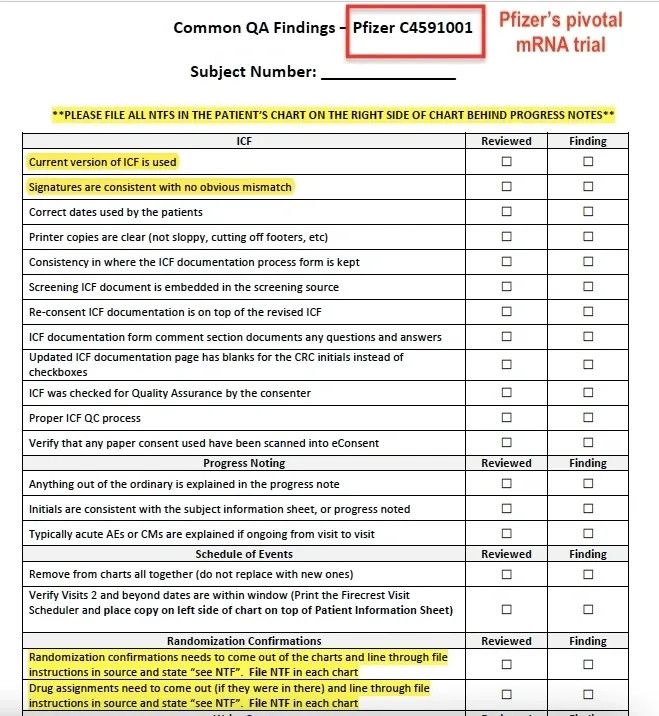
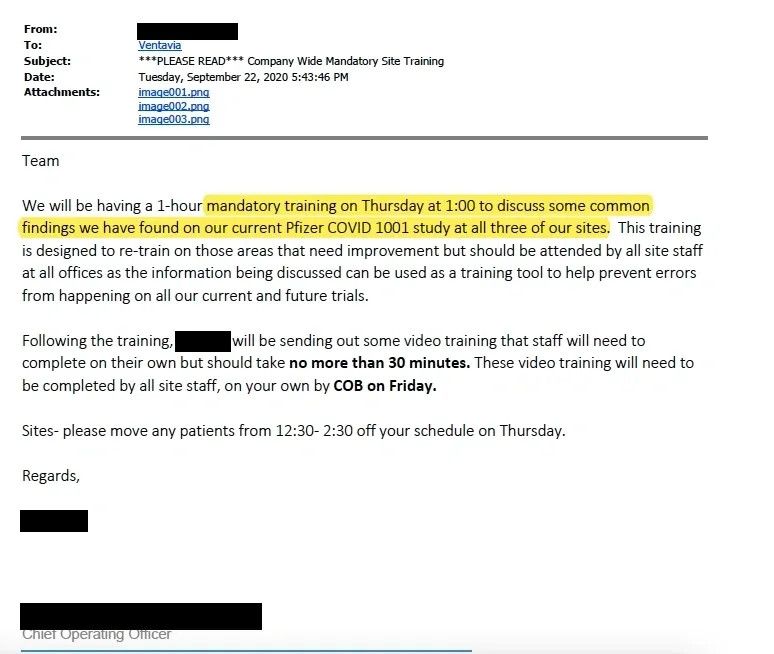
Nach der Einstellungspause weist eine E-Mail vom 22. September 2020 darauf hin, dass der Chief Operating Officer von Ventavia verlangte, dass alle Mitarbeiter obligatorisch geschult werden, um die wiederholten Fehler, die im Labor aufgetreten waren, zu vermeiden. (siehe E-Mail)
Ventavia war auch verpflichtet, Pfizer über die Pause zu informieren, aber die von Frau Jackson bereitgestellten Textnachrichten zwischen leitenden Mitarbeitern deuten darauf hin, dass sie die Gründe dafür nicht transparent machen wollten.
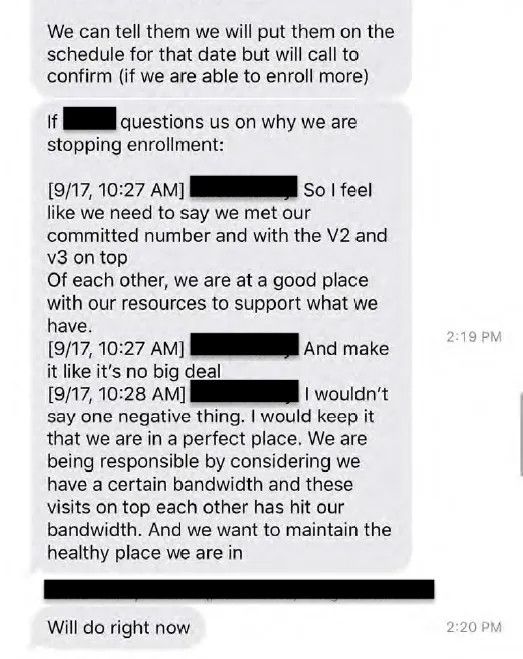
„Ich habe das Gefühl, dass wir sagen müssen, dass wir die zugesagte Zahl [der Teilnehmer] erreicht haben", sagte eine Mitarbeiterin. "Machen Sie es so, als ob es keine große Sache wäre. Ich würde nicht eine einzige negative Sache sagen. Ich würde sagen, dass wir uns an einem perfekten Ort befinden.“
Frau Jackson sagt, dass die Umgebung feindselig wurde, als sie ihre Bedenken bei Ventavia äußerte.
Nachdem sie am 25. September 2020 eine formelle Beschwerde bei der FDA eingereicht hatte, wurde sie noch am selben Tag entlassen.
Die FDA untersuchte die Örtlichkeit nicht, obwohl sie glaubwürdige Anschuldigungen wegen Fehlverhaltens in klinischen Studien erhielt.
Die Dokumente zeigen, dass die Probleme nicht auf ein einzelnes Problem oder einen einzelnen Mitarbeiter beschränkt waren, sondern allgegenwärtig und anhaltend waren, Patienten gefährdeten und wahrscheinlich die Datenintegrität beeinträchtigten.
„Können wir den Daten, die von Ventavia kommen, wirklich vertrauen, wenn man das Gesamtbild betrachtet? Nein.“
, sagte Frau Jackson.
Ventavia-Probleme dauern an
Durchgesickerte Dokumente deuten nun darauf hin, dass Probleme mit der Qualitätskontrolle in den aktuellen Phase-III-Studien nach der Beschwerde von Frau Jackson nicht behoben wurden.
Ein Dokument vom 14. September 2021 – ein Jahr nach der Entlassung von Frau Jackson – weist darauf hin, dass Ventavia immer noch Probleme mit der Nichteinhaltung der Vorschriften hat und schwerwiegende unerwünschte Ereignisse (SAE) nicht rechtzeitig meldet.

Ein weiteres Dokument weist darauf hin, dass das Personal keine Abstrichprobe von einem Teilnehmer entnommen hatte, der mit einem Unwohlsein zum Studienzentrum kam.

Als ihnen von maryannedemasi.com Fragen gestellt wurden, äußerten sich Ventavia und Pfizer nicht.
Die Daten, die die „Emergency Use Authorization“ des mRNA-Impfstoffs von Pfizer untermauern, wurden im Dezember 2020 im hochrangigen New England Journal of Medicine veröffentlicht.
Bisher wurde für das veröffentlichte Papier weder eine „Besorgnisäußerung“ registriert, noch wurde es zurückgezogen.
Wiederholte Anfragen nach Kommentaren des Chefredakteurs der Zeitschrift, Prof. Eric Rubin, und der Chefredakteurin Prof. Mary Beth Hamel, blieben unbeantwortet.
Die Whistleblowerin reflektiert
„Ich habe Probleme vom ersten Tag an erkannt. Im Laufe der Tage stellte ich fest, dass die Mängel nicht behoben wurden. Sie versuchten tatsächlich, sie zu vertuschen, und ich sagte ihnen, dass ich mich weigere, daran teilzunehmen, dass ich mich an ihrem Betrug nicht mitschuldig machen wollte“, sagt Frau Jackson.
„Ich hatte das Gefühl, dass Ventavia es auf mich abgesehen hatte, weil ich all diese Bedenken vorbrachte“, fügt sie hinzu.
Frau Jackson verstand die Bedeutung ihrer Anschuldigungen, weshalb sie zögerte, sie in die Medien zu bringen, aus Angst, als „Impfgegnerin“ abgetan zu werden.
„Ich war enttäuscht, dass einige sagen, dass diese Behauptungen nicht glaubwürdig sind. Aber andererseits war ich lange Zeit enttäuscht, weil Ventavia Abstriche machen durfte und die FDA ihren Job nicht gemacht hat“, sagt Frau Jackson.
Kurz nach ihrer Entlassung sagte Frau Jackson, sie habe wiederholt Telefonanrufe und Textnachrichten über die von ihr geäußerten Bedenken von Pfizers Anwalt erhalten, der ihre privaten Telefondaten hatte.
Frau Jackson beschrieb dies als „Einschüchterung“.
Wie geht es weiter?
Arzneimittelaufsichtsbehörden wie die TGA und die FDA haben die Aufgabe, die Öffentlichkeit zu schützen und unabhängige Bewertungen des Nutzens und der Sicherheit von Arzneimitteln durchzuführen.
Die von Frau Jackson geäußerten Bedenken haben jedoch deren Position nicht geändert.
Trotz wiederholt versprochener Transparenz hat die FDA einen US-Bundesrichter gebeten, die Öffentlichkeit bis 2076, also 55 Jahre, warten zu lassen, um die Gesamtheit der Daten und Informationen offenzulegen, auf die sie sich bei der Lizenzierung des COVID-19-Impfstoffs von Pfizer für Erwachsene stützte.
Die TGA hat bestritten, dass diese von Frau Jackson angesprochenen Probleme die Integrität der Daten beeinträchtigt haben. In einer Erklärung gegenüber maryannedemasi.com hieß es:
„Die im BMJ-Artikel erhobenen Anschuldigungen beziehen sich auf drei Standorte (ungefähr 2% der Studienpopulation) in den Vereinigten Staaten und es gibt keinen Hinweis darauf, dass andere Standorte involviert sein könnten. Daher geht die TGA-Bewertung davon aus, dass die Gesamtergebnisse voraussichtlich nicht beeinflusst werden.“
Die „2%“ der TGA scheinen auf der Annahme zu beruhen, dass es nur 1000 Teilnehmer an Ventavia-Standorten gab. Im September 2020, als Frau Jackson entlassen wurde, waren es jedoch 1000 Teilnehmer.
Ventavia war aktiv dabei, neue Teilnehmer zu rekrutieren, und eine jüngste Erklärung des BMJ deutet darauf hin, dass möglicherweise noch mehr Studienteilnehmer beteiligt sind und dass die Gesamtzahl der von Ventavia rekrutierten Teilnehmer noch unbekannt ist.
„Ein anderer ehemaliger Mitarbeiter von Ventavia hat dem BMJ mitgeteilt, dass Ventavia letztendlich viel mehr Teilnehmer für die klinische Studie von Pfizer rekrutiert hat, als Jackson der FDA gemeldet hatte. Weder Pfizer noch Ventavia werden auf Fragen des BMJ antworten, um zur Klärung dieser Angelegenheit beizutragen“, erklärte das BMJ.
Ventavia ist ein Unternehmen, das dem Platinum Research Network (PRN) angeschlossen ist, dem mindestens fünf weitere Unternehmen angehören, die Studienzentren für den Impfstoff COVID-19 von Pfizer betreiben.
Auf die Frage nach der Anzahl der für die Pfizer-Studie rekrutierten Teilnehmer und der Anzahl der von diesen Unternehmen betriebenen Studienzentren antwortete PRN nicht.
In der Anfangsphase der „Operation Warp Speed“ gab es einen wahnsinnigen Ansturm darauf, Teilnehmer zu rekrutieren und die Versuche in Rekordzeit zum Laufen zu bringen.
„Es bestand kein Zweifel daran, dass Geschwindigkeit und Eile die Einschreibungen bei Ventavia vorantrieben. Der Wettlauf von Pfizer, die Nummer eins zu werden, trieb die Einschreibungen an und bot Prämien an, wenn die Erwartungen an die Einschreibungen erfüllt wurden. Es stellt sich die Frage: Wenn es bei Ventavia so war, wo war es sonst noch so?“, sagt Frau Jackson.
Hat diese Notwendigkeit der Geschwindigkeit die Daten beeinträchtigt, auf deren Grundlage der Impfstoff zugelassen wurde? Die Antwort bleibt ungewiss.
Wenn Sie die Forschung von Maryanne Demasi unterstützen möchten, können Sie das hier tun.
