Experten äußern sich nach der Klage gegen die FDA auf Zugang zu Pfizer-Studiendaten

Dies ist wieder lediglich eine Übersetzung des Blogposts https://maryannedemasi.com/publications/f/experts-weigh-in-after-suing-fda-for-access-to-pfizer-trial-data von Maryanne Demasi, PhD
Es geht um zwei Themenkomplexe:
- Einforderung von Transparenz hinsichtlich der Forschungs- und Zulassungsdaten
- erste Ergebnisse der Veröffentlichungen, insbesondere bzgl. Nebenwirkungen
Im Dezember 2020 erteilte die US-Arzneimittelbehörde (FDA) eine Notfallzulassung für den mRNA-Impfstoff Covid-19 von Pfizer auf Basis von begrenzten Daten aus Phase-III-Studien.
In Anbetracht der Dringlichkeit der Pandemie wurde die Prüfung der Studiendaten schneller als üblich durchgeführt. Für eine Prüfung, die normalerweise durchschnittlich 10 Monate dauert, benötigte die FDA nur 108 Tage.
Das ließ sofort Zweifel an der Schnelligkeit aufkommen, mit der die Agentur ihre Entscheidung traf.
Im August 2021 erteilte die FDA die volle Zulassung für den mRNA-Impfstoff von Pfizer (Comirnaty), ohne die vollständigen Daten für die Öffentlichkeit zur unabhängigen Prüfung freizugeben.
Die Experten zeigten sich besorgt darüber, dass alle öffentlich zugänglichen Informationen über ein vollständig zugelassenes Produkt auf Zeitschriftenartikel, Pressemitteilungen und Bewertungen von Arzneimittelbehörden beschränkt waren, die allesamt Interessenkonflikten und Voreingenommenheit unterliegen.
Wissenschaftler demonstrieren für Transparenz
Eine Gruppe von über 80 Beamten des öffentlichen Gesundheitswesens und medizinischen Forschern bildete eine Allianz, um die Daten zu beschaffen und zu verbreiten, auf deren Grundlage die FDA ihre Entscheidung zur Zulassung des Impfstoffs von Pfizer traf.
Die gemeinnützige Gruppe mit dem Namen Public Health and Medical Professionals for Transparency (PHMPT) reichte im September 2021 eine Klage beim US-Bezirksgericht in Fort Worth, Texas, ein. Der in den USA ansässige Arzt Dr. Aaron Kheriaty ist eines der Mitglieder, der die Klage anführt.
"Eine Gruppe von uns war besorgt über das Studiendesign, die verkürzte Dauer der klinischen Studie und das Flickwerk, das für die Überwachung von unerwünschten Ereignissen nach dem Inverkehrbringen eingerichtet wurde", so Dr. Kheriaty.
So durfte Pfizer beispielsweise seine Kontrollgruppe nach nur zwei Monaten beenden.
"Die Placebogruppe wurde im Grunde genommen eliminiert, weil der Impfstoff allen angeboten wurde, die das Placebo bekamen, so dass es nicht gelang, eine Kontrollgruppe aufrechtzuerhalten", so Dr. Kheriaty.
In der Klage gegen den Freedom of Information Act (FOIA) wurde festgelegt, dass die Daten und Informationen in den bei der FDA eingereichten Dokumenten nach Bundesrecht der Öffentlichkeit zugänglich gemacht werden sollten, sofern keine außergewöhnlichen Umstände vorliegen.
Ziel war es, die Transparenz und Rechenschaftspflicht der Regierung zu gewährleisten.
Prof. Tom Jefferson ist ein weiteres Mitglied des PHMPT und der Covid-19-Arbeitsgruppe der WHO für Infektionsprävention und -kontrolle. Seiner Meinung nach kann die Bedeutung einer unabhängigen Überprüfung der wissenschaftlichen Daten nicht hoch genug eingeschätzt werden.
"Zensur und mangelnde Transparenz waren schon immer die Feinde des Fortschritts. Im Fall der Covid-19-Impfstoffe wird die Bedeutung der Transparenz durch die massenhafte Verabreichung an die gesunde Bevölkerung und die unbekannten Langzeitwirkungen noch verstärkt", sagte Prof. Jefferson.
"Angesichts der unzureichenden und überstürzten Tests und der Geheimhaltungskultur ist es fraglich, ob eine informierte Zustimmung gültig ist, bevor alle Dokumente, die der FDA vorliegen, veröffentlicht wurden", fügte er hinzu.
Der Impfstoff von Pfizer war Gegenstand heftiger Debatten, unter anderem wegen zu geringer Angaben zu unerwünschten Ereignissen, Fälschung von Daten und mangelnder Wirksamkeit.
FDA bittet um Verzögerung der Veröffentlichung der Dokumente
Während die FDA sagt, dass sie sich für Transparenz einsetzt, schlägt die Behörde vor, die Dokumente von Pfizer über mehrere Jahrzehnte hinweg an die Öffentlichkeit weiterzugeben.
Die Anwälte des Justizministeriums (DOJ), die die FDA vertreten, baten den Bundesrichter, ihnen 75 Jahre für die Bearbeitung des FOIA-Antrags zuzugestehen, was das Enddatum für die endgültige Freigabe der Dokumente auf das Jahr 2096 verschiebt.
Sie argumentierten, dass die sofortige Freigabe von 451.000 Seiten an Dokumenten eine zu große Belastung darstellen würde, da die Agentur nicht über genügend Personal verfüge, und dass sie nur 500 Seiten pro Monat freigeben könne, um die Schwärzung von ausgenommenem Material wie Geschäftsgeheimnissen zu ermöglichen.
"Die Vorstellung, dass die FDA mit 18.000 Mitarbeitern und 6,5 Milliarden Dollar an Finanzmitteln nicht in der Lage ist, die Dokumente schneller zu erstellen, ist absurd", sagt Aaron Siri, US-Anwalt im Namen des Klägers PHMPT.
"Es ist dystopisch, wenn die Regierung Pfizer Milliarden gibt, den Amerikanern vorschreibt, ihr Produkt einzunehmen, den Amerikanern verbietet, wegen Schäden zu klagen, aber den Amerikanern die Einsicht in die Daten verweigert, die der Zulassung zugrunde liegen".
"Die FDA hat nicht bestritten, dass sie diese Dokumente vorlegen sollte", sagte Herr Siri, "vielmehr schlägt sie vor, dies so langsam zu tun, dass die Dokumente erst dann vollständig vorgelegt werden, wenn fast alle Wissenschaftler, Anwälte und die meisten Amerikaner, die das Produkt von Pfizer erhalten haben, an Altersschwäche gestorben sind."
Die FDA entgegnete, es sei unzumutbar, von ihr zu erwarten, dass sie den Forderungen nachkomme, da sie nur 10 Mitarbeiter habe, die FOIA-Anfragen bearbeiteten. Herr Siri sagt, das sei keine Entschuldigung.
"Es gibt zahlreiche Fälle, in denen andere Agenturen, die sich mit einer Produktion befassen, die für eine beschleunigte Bearbeitung in Frage kommt, Personal versetzt oder mehr Personal eingestellt hat, um ihren gesetzlichen Verpflichtungen unverzüglich nachzukommen", sagt Herr Siri.
In der Antwort des Justizministeriums an das Gericht wurde eingeräumt, dass die FDA seit 2018 auf Vorladungen der Bundesbehörden reagiert hat, und zwar mit schnellen Bearbeitungszeiten für Produktionen, die jeweils Hunderttausende von Seiten erfordert hätten.
Was ergab die erste Veröffentlichung der Dokumente?
Ein Stapel von Pfizer-Dokumenten wurde bereits von der FDA freigegeben.
Dr. Kheriaty sagte, dass es in den Medien viel Wirbel um die Bedeutung der Dokumente gegeben habe, dass aber noch viele Informationen fehlten und er daher vorsichtig sei, die Daten nicht überzuinterpretieren.
So wurde z. B. behauptet, aus den Dokumenten gehe hervor, dass innerhalb der ersten 90 Tage nach der Einführung des Impfstoffs 1223 Menschen an den Folgen des Impfstoffs gestorben seien, doch die Realität ist differenzierter.
"Im Grunde haben wir nur rohe Zahlen. Wenn man sich das Dokument ansieht, wurden Informationen darüber, wie viele Dosen von Pfizer ausgeliefert wurden, geschwärzt. Wenn wir also nicht wissen, wie viele Dosen insgesamt verabreicht wurden, können wir nicht feststellen, bei welchem Prozentsatz der Personen, die den Impfstoff erhalten haben, diese unerwünschten Ereignisse aufgetreten sein könnten", erklärte Dr. Kheriaty.
Dennoch erschien Dr. Kheriaty die Zahl der gemeldeten Todesfälle, die Pfizer in der Anfangsphase der Einführung des Impfstoffs erhielt, als "hoch".
"Das ist ein enormer Anstieg, der als deutliches Sicherheitssignal gewertet werden sollte", sagte Dr. Kheriaty.
"Wenn man sich die unerwünschten Ereignisse ansieht, die in den letzten 20 Jahren für die Covid-Impfstoffe im Vergleich zu den Grippeimpfstoffen gemeldet wurden, so haben wir eine um Größenordnungen höhere Zahl von unerwünschten Ereignissen, einschließlich Todesfällen, festgestellt." (siehe Grafik)
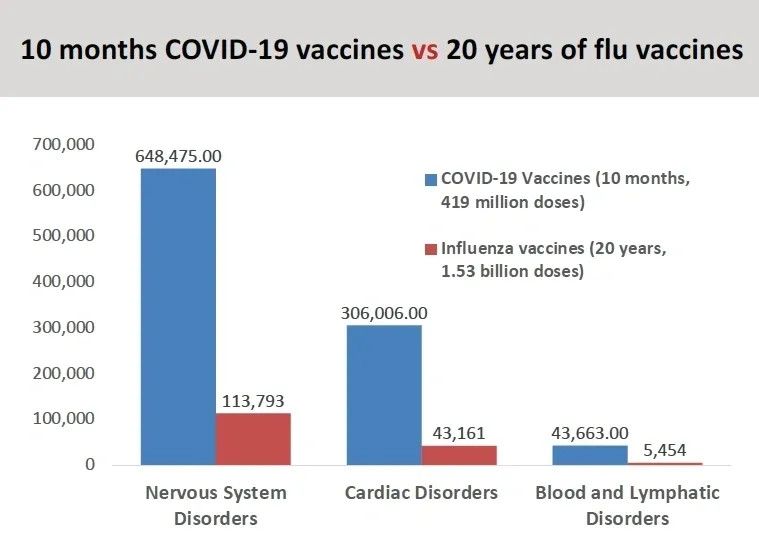
Außerdem verwies er auf den Anhang in einem der Pfizer-Dokumente (Seite 30), in dem auf neun Seiten die gemeldeten unerwünschten Ereignisse aufgeführt sind.
Auch wenn keine kausalen Schlüsse gezogen werden können, deutet Dr. Kheriaty an, dass die Liste einige beunruhigende Signale enthält.
"Ich sehe viele neurologische Probleme und ich sehe viele Autoimmunprobleme", sagte er.
"Wenn man sich das Merkblatt anschaut, das den Empfängern des Pfizer-Impfstoffs ausgehändigt wurde, werden etwa 21 mögliche Nebenwirkungen aus der Studie aufgeführt, von denen die meisten harmlos sind. Im Gegensatz dazu sind die in den ersten 90 Tagen der Nachbeobachtung gemeldeten unerwünschten Ereignisse sehr besorgniserregend."
Solange nicht alle Daten veröffentlicht sind, kann keine endgültige Bewertung vorgenommen werden.
Prof. Jefferson vertritt eine ähnliche Ansicht.
Die von Pfizer bei der FDA eingereichten Dokumente werden wahrscheinlich einer internationalen Standardstruktur folgen - dem sogenannten Common Technical Document (CTD), das aus fünf Modulen besteht.
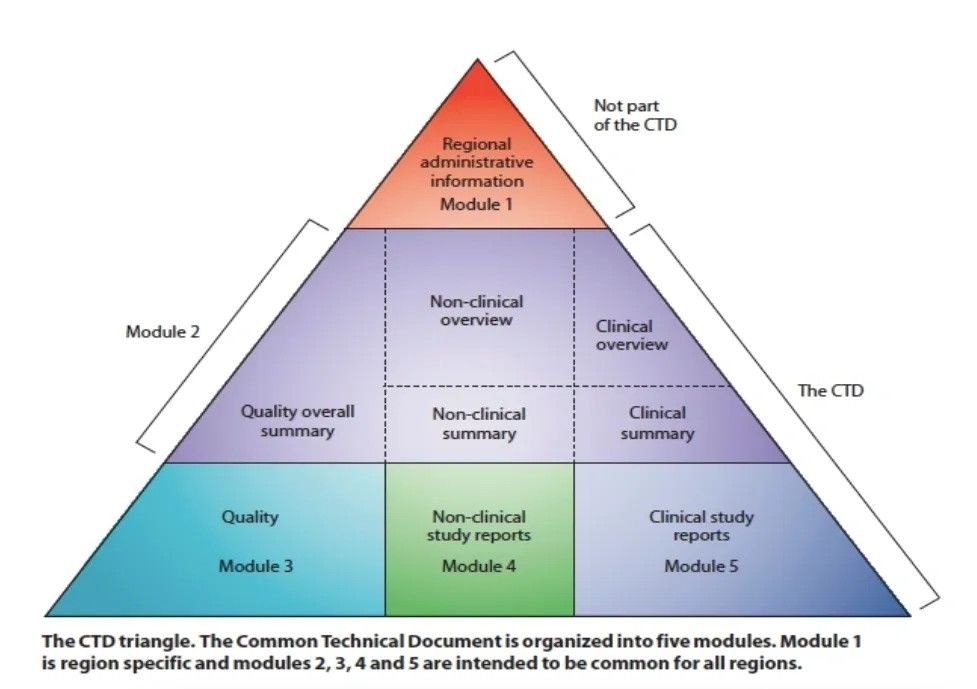
"Die teilweise, unvollständige oder stapelweise Freigabe von Teilen des CTD erschwert eine kohärente Bewertung des Antrags und kann zu Fehlern bei der Interpretation seines Inhalts führen", sagt Prof. Jefferson.
Wenn die Module nicht in der richtigen Reihenfolge freigegeben werden - wie es die FDA jetzt tut -, wird die Analyse verfälscht.
"Das Fehlen auch nur eines einzigen Datensatzes könnte jede Analyse von Wissenschaftlern verfälschen, die versuchen, die Daten von Pfizer ordnungsgemäß zu überprüfen, weshalb sie alle sofort freigegeben werden sollten", sagte er.
Was nun?
Während die FDA bereits einen Stapel von Pfizers Dokumenten freigegeben hat, sagt Herr Siri, dass der Richter noch nicht entschieden hat, wie die FDA vorgehen soll.
"Es ist noch keine Entscheidung in diesem Fall ergangen, und alle bisher vorgelegten Dokumente wurden von der FDA offenbar in der Hoffnung vorgelegt, eine eventuelle Entscheidung des Gerichts abzumildern", sagt er.
Eine endgültige Entscheidung des Richters über den Zeitrahmen, in dem die FDA ihre Dokumente herausgeben muss, könnte in den nächsten Wochen getroffen werden, sofern die Anhörung nicht vertagt wird.
Sie können die Forschungsarbeiten von Maryanne Demasie unterstützen, indem Sie diesen Link folgen.
